|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фармацевтическая
химия
|
|
|
Аргентометрия Меркуриметрия Комплексонометрия Нитритометрия Йодометрия Йодатометрия Йодхлорометрия Броматометрия Перманганатометрия Цериметрия |
Аргентометрия
Метод Мора. Прямая
аргентометрия.
Только
для Cl–, Br–; (не исп
для I–). Титрант – AgNO3, индикатор – K2CrO4, среда: pH=6–8. NaBr + AgNO3 → AgBr↓ + NaNO3, K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3. fэкв(NaBr)=1, Недопустимо: рН<6: CrO72– + 2H+ → Сr2O72– + H2O, рН>8: 2Ag+ + 2OH– → Ag2O + H2O. Присутствие ионов: SO42–, S2–, PO43–,
AsO33–, BO33–, CO32–;
Bi3+, Ba2+, Pb2+. Метод Фаянса. Прямая
аргентометрия.
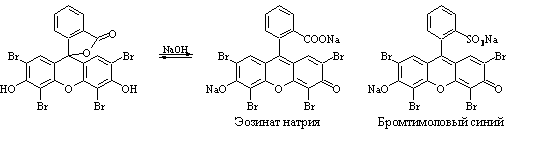
Титрант – AgNO3, индикаторы – эозинат натрия (Br–,I–), бромтимоловый синий (Cl–), среда – CH3COOH
(30%).
NaI + AgNO3 → AgI↓ + NaNO3. Йодид серебра адсорбирует на себе одноименные
ионы; появляется ярко-розовая окраска: {m(AgI)∙nI–(n–x)K+}x– В точке эквивалентности коллоидная частица
становится электронейтральной, в КТТ начинает
адсорбировать Ag+; идет перезарядка мицеллы, осадок коагулирует,
раствор просветляется: {m(AgI)∙nI–(n–x)K+}x–∙xAg+, {m(AgI)∙nI–(n–x)K+}x–∙xAg+ + Ind2– → (x/2)Ag2Ind + {m(AgI)∙nI–(n–x)K+}x–. fэкв(NaI)=1, Метод Фольдгарда. Обратная аргентометрия.
Титранты – 1) AgNO3, 2) NH4SCN; Индикаторы – NH4Fe(SO4)2 (Cl–, Br–), FeCl3 (I–); Среда – HNO3 (pH=3). К
раствору навески препарата прибавляют HNO3, точный избыточный объем AgNO3 и индикатор: KBr + AgNO3 → AgBr↓ + KNO3, AgNO3 + NH4SCN → AgSCN↓ + NH4NO3; В КТТ индикатор взаимодействует с титрантом: 3NH4SCN + NH4Fe(SO4)2 → Fe(SCN)3 + 2(NH4)2SO4. fэкв(KI)=1, Преимущества пред другими методами: 1.
Сильнокислая среда, 2.
Не мешают другие ионы; Недостатки: 1.
Меньшая точность (обратный метод), Особенности титрования хлоридов: 1.
Низкая скорость титрования [Ks(AgCl)>Ks(AgCNS)], 2.
Очень слабое перемешивание, 3.
Добавление толуола или бензола для экстракции AgCl. Особенности титрования йодидов: После
добавления нитрата серебра ждут полного осаждения AgI, второй индикатор добавляют перед самым титрованием: 2KI + 2FeCl3 → I2 + 2FeCl2 + 2KCl. Метод Кальтгофа–Стенглера. /Только
для Br–/
Титранты – 1) AgNO3, 2) NH4SCN,
индикатор – NH4Fe(SO4)2, среда – HNO3 (pH=3). К раствору навески препарата прибавляют HNO3, индикатор и точный
избыточный объем NH4SCN (0,1 мл): 3NH4SCN + NH4Fe(SO4)2 → Fe(SNS)3 + 2(NH4)2SO4. Титруют нитратом серебра до исчезновения красного
окрашивания: KBr + AgNO3 → AgBr↓ + KNO3, AgNO3 + NH4SCN → AgSCN↓ + NH4NO3, 3AgNO3 + Fe(SCN)3 → 3AgSCN + Fe(NO3)3. fэкв(KBr)=1, Метод Кальтгофа (Йодкрахмальный).
/Для I– в присутствии Cl–
и Br–/
Титрант – AgNO3, индикатор – крахмал,
среда – H2SO4. К
ратсвору навески препарата прибавляют 1 каплю KIO3 (0,1 моль/л), раствор
крахмала и H2SO4 (1:5) до появления синего
окрашивания: 5KI + KIO3 + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O, Титруют AgNO3
(0,1 моль/л) до исчезновения синего окрашивания (после удаления йодида): KI + AgNO3 → AgI↓ + KNO3. fэкв(KI)=1, Аргентометрия с внешним индикатором. /Для I–/
Титрант – AgNO3, индикатор – нитриткрахмальная бумага, среда – H2SO4. К раствору навески препарата добавляют H2SO4 (1:5), титруют AgNO3. Вблизи точки
эквивалентности после каждого раза прибавления титранта
наносят каплю раствора на нитриткрахмальную бумагу.
Титрование заканчивают, когда синего окрашивания на бумаге от прибавления
раствора не будет: NaI + AgNO3 → AgI↓ + NaNO3, 2KI + 2KNO2 +2H2SO4 → I2 + 2NO + 2K2SO4 + 2H2O. fэкв(NaI)=1, |
|
|
|
|
|