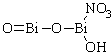|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Висмута нитрат основной |
Bismuthi subnitras – Висмута
нитрат основной
Bismuthum subnitrikum Описание. Белый аморфный или микрокристаллический
порошок. Препарат, смоченной водой, окрашивает синюю лакмусовую бумагу в
красный цвет. Растворимость. Практически нерастворим в воде и спирте, легко растворим в азотной и
соляной кислотах. Получение. Источник – висмутовые, свинцовые
или медные руды: 4BiOCl + 2Na2CO3 + 3C → 4Bi + 4NaCl + 5CO2, Bi + 4HNO3 →Bi(NO3)3 + NO↑ + 2H2O. При выпаривании раствора
выпадают бесцветные кристаллы Bi(NO3)3·5H2O; при
растворении в воде гидролизуются: Bi(NO3)3 + 2H2O → Bi(OH)2NO3 + 4HNO3. Подлинность. 1. Прокаливание
(ГФХ). Выделение бурых паров
оксида азота (II);
сухой остаток приобретает желтый цвет (Bi2O3): 4Bi(O)NO3 → 2Bi2O3↓ + 4NO2↑ + O2↑. 2. Образование черного осадка сульфида висмута
в солянокислой среде (ГФХ): 2Bi(O)NO3 + 3Na2S +4HCl → Bi2S3↓ + 2NaNO3 + 4NaCl + 2H2O. 3. Реакция с йодидом калия в
сернокислой среде (ГФХ).
Образование йодида висмута (черный осадок), растворимого в избытке реактива с
образованием оранжевого раствора: Bi(NO3)3 + 3KI → BiI3↓ + 3KNO3, BiI3 + KI → K[BiI4]. 4. Реакция со щелочным раствором гидрокисламина гидрохлоридом
(выпадение черного осадка металлического висмута): 2Bi(NO3)3 + NH2OH → 2Bi↓ + 3N2↑ + 6HNO3 + 6H2O. Чистота. Кислотность. Примеси. Допустимые: Хлориды, соли щелочных и щелочноземельных металлов,
карбонаты, серебро. Недопустимые: Соли аммония, медь, свинец, сульфаты,
мышьяк и теллур. Количественное определение. 1.
Комплексонометрическое титрование. Титрант – ЭДТА, индикатор – пирокатехиновый фиолетовый,
среда – HNO3.
Хранение. В
хорошо укупоренной таре, предохраняющей от
действия света. Применение.
Вяжущее средство. |
|
|
|
|
|