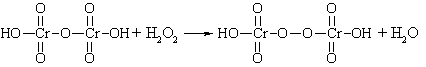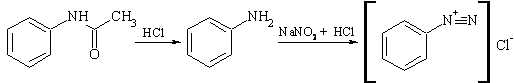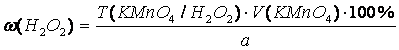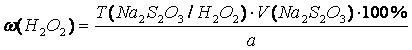|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Препараты VIA группы
периодической системы
|
|
|
Кислород Водорода пероксид Сера осажденная |
Solutio hydrogenii peroxydi – Раствор перекиси водорода
H2O2 М.м.
34,01 Описание. Бесцветная прозрачная
жидкость без запаха или со слабым своеобразным запахом, слабокислой реакции.
Быстро разлагается на свету, при нагревании, соприкосновении с окисляющими
или восстанавливающими веществами, щелочами, некоторыми металлами (железо,
марганец, медь), выделяя кислород. Получение. 1.
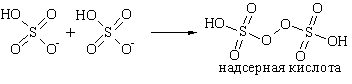
Электролиз
концентрированной серной кислоты: H2SO4 ↔ 2H+ + SO42–; A(+): 2HSO4– – 2ē → H2S2O8, K(–): 2H+ + 2ē → H2; 2H2SO4 → H2S2O8 +H2↑;
H2S2O8 + H2O → + H2O2 + H2SO4. В промышленности
электролизу подвергают кислые растворы сульфата аммония: 2NH4HSO4 → (NH4)2S2O8 + H2↑, (NH4)2S2O8 + H2O → H2O2 + 2NH4HSO4. Концентрированные растворы
водорода перекиси получают из разбавленных путем перегонки в вакууме при
нормальной температуре. 2.
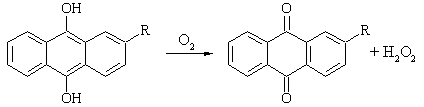
Автоокисление воздухом
производных алкилантрахинонов (R – 2‑этил, 2‑трет-бутил, 2-пентил):
Подлинность. 1.
Образование надхромовых
кислот. К раствору водорода
перекиси, подкисленному серной кислотой, прибавляют эфир и несколько капель
бихромата калия; органический слой окрашивается в синий цвет: K2Cr2O7 + H2SO4 → H2Cr2O7 +K2SO4,
2.
Окисление йодидов. Слой хлороформа
окрашивается в малиновый цвет: H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O. 3.
Определение подлинности
антифебрина (ацетанилида). Определенное количество препарата упаривают, к сухому
остатку (антифебрин) прибавляют кислоту соляную и кипятят. После охлаждения
проводят реакцию на первичный ароматический амин (образование азокрасителя):
Свойства. Водорода перекись
разлагается на свету, при нагревании или при соприкосновении с
катализаторами, окислителями или восстановителями: 2H2O2 → 2H2O + O2↑. Катализаторы – платиновая чернь, MnO2, Mn2+, Cu2+, щелочи, уголь. Ингибиторы – антифебрин
(ацетанилид), натрия бензоат, натрия пирофосфат (Na4P2O7), мочевая, салициловая,
щавелевая кислоты, барбитал. 1.
Кислотные свойства. В
водном растворе водорода перекись диссоциирует по уравнению: Н2О2 + Н2О ↔ Н3О+ + НОО–. Ион НОО–
являясь сильным окислителем, взаимодействует с недиссоциированной молекулой Н2О2
с образованием кислорода: Н2О2 + НОО– → О2↑ + Н2О + ОН–. Вследствие протекания этой
реакции щелочные растворы Н2О2 неустойчивы. Водорода
перекись взаимодействует с гидроксидами с образованием пероксидов: H2O2 + Ba(OH)2 → BaO2 + 2H2O, NaOH + H2O2 → NaHO2 + H2O. 2.
Восстановительные
свойства.
Благоприятствует щелочная среда. H2O2 + Cl2 → 2HCl + O2, H2O2 + Ag2O → 2Ag + H2O + O2, 5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 +8H2O. 3.
Окислительные свойства. Благоприятствует кислая
среда. H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O, H2O2 + 2KBr + H2SO4 → Br2 + K2SO4 + 2H2O, 3H2O2 + Cr2(SO4)3 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O, 4H2O2 + PbS → PbSO4 + 4H2O, H2O2 + 2FeSO4 + H2SO4 → Fe2(SO4)3 + 2H2O. Количественное определение. 1.
Прямая перманганатометрия (ГФ Х). Титрант и индикатор – KMnO4, среда – H2SO4. 2MnO4– + 5H2O2 + 6H+ → 2Mn2+ + 5O2 +8H2O. Водорода перекись
окисляется до кислорода: H2O2 – 2ē → O2 + 2H+, fэкв(H2O2)=1/2, 2.
Косвенная йодометрия. Титрант – Na2S2O3, индикатор – крахмал, среда
– H2SO4. H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O. I2 + 2Na2S2O3 → Na2S4O6 + 2NaI. Водорода перекись
восстанавливается до воды: H2O2 + 2H+ + 2ē → 2H2O, fэкв(H2O2)=1/2, 3.
Прямая цериметрия. 4.
Фотоколориметрия. Окисление сульфата железа
(II), образование красного роданида железа (III): H2O2 + 2FeSO4 + H2SO4 → Fe2(SO4)3 + 2H2O, Fe2(SO4)3 + 6NH4CNS → 2Fe(CNS)3 +3(NH4)2SO4. Используются также окисд
меди (II), фенолфталеин, флюоресцин, дифениламин и др. 5.
Спектрофотометрия. 6.
Рефрактометрия. Препараты
перекиси водорода
Solutio hydrogenii peroxydi diluta – раствор перекиси
водорода (2,7 – 3,3%). Hydroperitum – гидроперит (NH2)2CO∙H2O2 (33 – 35%) – белый
кристаллический порошок. Образует раствор перекиси водорода при растворении в
воде: (NH2)2CO∙H2O2 → H2O2 + (NH2)2CO. При нагревании выше 60°С выделяет кислород: 2(NH2)2CO∙H2O2 → O2 + 2(NH2)2CO + 2H2O. Используется в качестве бактерицидного средства
для полоскания рта и горла. Таблетки гидроперита хранят в хорошо закрытых темных
склянках при температуре не выше 20°С. Perhydrolum – пергидроль (27,5 – 31,0%) применяется для
приготовления разбавленных растворов перекиси водорода. Magnesii peroxydum – магния пероксид MgO/MgO2 (25% MgO2) выделяет перекись
водорода при действии кислот: MgO2 + 2HCl → H2O2 + MgCl2. Применяется внутрь при заболеваниях
желудочно-кишечного тракта как дезинфицирующее средство, препятствующее
брожению. |
|
|
|
|
|