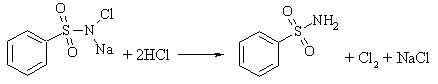
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Препараты
VIIA группы
периодической системы
|
|
|
Натрия хлорид Калия хлорид Натрия бромид Калия бромид Натрия йодид Калия йодид |
Галогениды щелочных металлов
Описание. Белые кубические кристаллы
или белый кристаллический порошки без запаха, соленого вкуса. Растворимость. Растворимы воде, МР или
ПНР в спирте. Подлинность. 1.
Ион натрия: 1.1. Реакция с раствором цинк-уранил-ацетата (ГФ Х) с образованием желтого мелкокристаллического осадка: NaCl+Zn(UO2)3(CH3COO)8+CH3COOH+9H2O→NaZn(UO2)3(CH3COO)9 ∙9H2O↓+HCl. 1.2. Спектроскопическая реакция (ГФ
Х). Окрашивание бесцветного
пламени в желтый цвет. 2.
Ион калия: 2.1. Реакция с раствором винной кислоты (ГФ Х). Выпадение белого осадка
гидротартрата калия при добавлении раствора винной кислоты к раствору соли
калия (добавление спирта 95% – соосадитель и CH3COONa
– буфер): C4H6O6 + CH3COONa + KCl Осадок гидротартрата калия растворим в растворе хлористоводородной
кислоты и нерастворим в растворе щелочи: C4H5O6K + HCl → C4H6O6 + KCl; C4H5O6K + NaOH →/ Недопустимо
содержание ионов NH4+, Rb+, Cs+ вследствие образования
аналогичных осадков. 2.2. Спектроскопическая реакция (ГФ
Х). Окрашивание бесцветного пламени
в фиолетовый цвет. 2.3. Реакция с гексанитрокобальтиатом (III) натрия. Удаление солей аммония
путем связывания в уроторопин: 6CH2O + 4NH4+ + 4OH– → (CH2)4N4 + 10H2O. Раствор гексанитрокобальтиата (III)
натрия с раствором соли калия дает желто-оранжевый осадок
гексанитрокобальтиата (III) калия-натрия: 2K+ + 2Na+ + [Co(NO2)6]3– Недопустимо: 1)
Кислая реакция среды: K2Na[Co(NO2)6] + 6Н+ → 6НNO2 + Со3+ + Na+ + 2K+; 2Со3+ + НNO2 + H2O → 2Со2+ + NO3– +3Н+; 2НNO2 → H2O + NO↑ + NO2↑. 2) Щелочная реакция среды: [Co(NO2)6]3– + 3ОН–→ Co(OН)3↓ + 6NO2–. 3) Наличие окислителей. 4)
Наличие восстановителей. 3.
Хлориды: 3.1. Реакция с нитратом серебра: (ГФ
Х): NaCl + AgNO3 AgCl + 2NH4OH(10%) → [Ag(NH3)2]Cl + 2H2O. 4.
Бромиды: 4.1. Реакция с раствором хлорамина Б (ГФ
Х). Слой
хлороформа окрашивается в желто-бурый цвет за счет экстракции брома:
2NaBr + Cl2 → Br2 + 2NaCl. 4.2. Реакция с нитратом серебра (ГФ
Х).
Выпадение желтоватого садка бромида серебра, нерастворимого в NH4OH(10%): NaBr + AgNO3 AgBr + 2NH4OH(10%) →/, AgBr + 2NH4OH(25%) → [Ag(NH3)2]Br + 2H2O. 4.3. Взаимодействие с окислителями. Слой хлороформа окрашивается в желто-бурый
цвет за счет экстракции брома: 2NaBr + 2NaNO2 + 2H2SO4 → Br2 + 2NO↑ + 2Na2SO4 + 2H2O. 5.
Йодиды: 5.1. Реакция с раствором нитрата серебра (ГФ Х) – выпадение желтого осадка йодида серебра, нерастворимого в 10% и 25%
растворах NH4OH: NaI + AgNO3 5.2. Реакция восстановления нитрита натрия в сернокислой среде. Слой хлороформа
окрашивается в малиновый цвет за счет экстракции йода: 2NaI + 2NaNO2 + 2H2SO4(разб.) → I2 + 2NO↑ + 2Na2SO4 + 2H2O. 5.3. Реакция восстановления хлорида железа (III).
Слой хлороформа окрашивается в малиновый цвет за счет экстракции йода: 2NaI + 2FeCl3 → I2 + 2FeCl2 + 2NaCl. 5.4. Взаимодействие твердой соли с концентрированной серной кислотой – выделение фиолетовых паров
йода и запах сероводорода: 8NaI + 5H2SO4 → 4I2↑ + H2S↑ + 4Na2SO4 + 4H2O. Чистота. 1.
Прозрачность и цветность раствора, 2.
Кислотность или щелочность. Примеси. Допустимые: кальций, соли аммония, тяжелые металлы,
сульфаты, мышьяк. Недопутимые: магний,
барий,
железо, ион-антагонист (по
физиологическому действию). NaBr, KBr – йодиды, барий, кальций,
броматы. NaI, KI – цианиды, нитраты, барий, йодноватая кислота, тиосульфаты, сульфиты. Количественное
определение. 1.
Метод
Мора (ГФ Х) – NaCl, KCl, NaBr, KBr. 2.
Метод Фаянса (ГФ Х) – NaI, KI. 3.
Метод Фольдгарда. 4.
Меркуриметрия. 5.
Йодатометрия. 6.
Перманганатометрия. 7.
Броматометрия. Хранение. В хорошо закупоренной таре, бромиды и йодиды – в
склянках из темного стекла в защищенном от света месте. Применение. NaCl – приготовление
солевых (гипо-, изо-, гипертонических) растворов, плазмозаменяющих жидкостей,
физиологических растворов. KCl – источник ионов калия
при гипокалиемии, антиаритмическое
средство, входит в состав плазмозаменителей. NaBr, KBr – cедативное средство;
внутривенно или перорально (микстуры). NaI, KI – При
недостатке йода в организме, воспалительных заболеваниях; входит в состав
глазных капель. |
||||||
|
|
|
||||||
|
|